19世纪后期,俄罗斯化学家德米特里·门捷列夫(Dmitri Mendeleev)发表了他的首次尝试,根据原子量对化学元素进行分组。当时只有大约60个元素已知,但门捷列夫意识到,当元素按权重组织时,某些类型的元素以规则的间隔或周期发生。
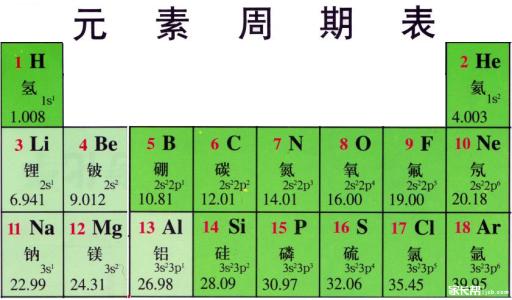
150年后的今天,化学家们正式认可了118种元素(在2016年增加了 4位新人之后),并且仍然使用门捷列夫的元素周期表来组织它们。该表以最简单的原子氢开始,然后用原子序数组织其余元素,原子序数是每个元素包含的质子数。除少数例外情况外,元素的顺序与每个原子的质量增加相对应。
该表有七行18列。每行代表一个时期; 元素的周期数表示其能量水平中有多少容纳电子。例如,钠位于第三个时期,这意味着钠原子通常在前三个能级中具有电子。向下移动,周期更长,因为它需要更多的电子来填充更大和更复杂的外层。
表的列表示元素的组或族。一组中的元素通常看起来和表现相似,因为它们在最外层的壳中具有相同数量的电子 - 它们向世界展示的面貌。例如,在桌子的最右侧的第18组元件具有完全完整的外壳并且很少参与化学反应。
元素通常被分类为金属或非金属,但两者之间的分界线是模糊的。金属元素通常是良好的电和热导体。金属中的亚组基于这些集合的类似特征和化学特性。根据洛斯阿拉莫斯国家实验室的说法,我们对元素周期表的描述使用了普遍接受的元素分组。
碱金属:碱金属占第1组的大部分,第1组是该表的第1列。这些金属的光泽和柔软足以用刀切割,这些金属以锂(Li)开始, 以fran(Fr)结束 。他们也非常反应,并 燃起火焰,甚至在与水接触发生爆炸,所以化学家将它们存储在油或惰性气体。具有单电子的氢也存在于第1组中,但该气体被认为是非金属的。
碱土金属:碱土金属构成元素周期表第2族,从 铍(Be)到 镭(Ra)。这些元素中的每一个在其最外层能量水平上都有两个电子,这使得碱土金属具有足够的反应性,因此它们在自然界中很少被发现。但它们不像碱金属那样具有反应性。与碱金属相比,它们的化学反应通常发生得更慢并产生更少的热量。
镧系元素:第三组太长了,无法放入第三列,所以它被打破并侧向翻转成为浮在桌子底部的岛的顶行。这是镧系元素,元素57至71- 镧(La)至 l(Lu)。该组中的元素具有银白色,与空气接触时会失去光泽。
Act系元素:act系元素排列在岛的底行,包括元素89, act(Ac),至103, law(Lr)。在这些元素中,只有 钍(Th)和 铀(U)在地球上大量存在。所有都是放射性的。act系元素和镧系元素一起形成称为内过渡金属的基团。
过渡金属:返回到表的主体,第3至12组的其余部分代表过渡金属的其余部分。这些元素坚硬但具有延展性,有光泽,并且具有良好的导电性,这些元素是您在听到金属这个词时通常会想到的。金属世界中许多最伟大的热门歌曲 - 包括金,银,铁和铂金 - 都住在这里。
后过渡金属:在进入非金属世界之前,共享特征并未沿垂直组线整齐划分。后过渡金属是 铝(Al), 镓(Ga), 铟(In), 铊(Tl), 锡(Sn), 铅(Pb)和 铋(Bi),它们跨越第13族至第17族。这些元素具有过渡金属的一些典型特征,但它们往往比其他过渡金属更柔软,导电性更差。许多元素周期表将在连接硼和ast的对角线下方加上一条粗体“阶梯”线。后过渡金属聚集在该线的左下方。
类金属:类金属是 硼(B), 硅(Si), 锗(Ge), 砷(As), 锑(Sb), 碲(Te)和 pol(Po)。它们形成了代表从金属到非金属逐渐过渡的楼梯。这些元素有时表现为半导体(B,Si,Ge)而不是导体。类金属也被称为“半金属”或“贫金属”。
非金属:楼梯右上角的其他所有东西 - 再加上 氢气(H),滞留在第1组 - 是非金属的。这些包括 碳(C), 氮(N), 磷(P), 氧(O), 硫(S)和 硒(Se)。
卤素:第17组的前四个元素,从 氟(F)到 ast(At),代表非金属的两个子集之一。卤素具有 很强的化学反应性,倾向于与碱金属配对产生各种盐。例如,厨房里的食盐是碱金属钠和卤素氯之间的结合。
高贵的气体:无色,无味,几乎完全不反应,惰性或稀有气体排在第18组的桌子上。许多化学家都希望oganesson(四个新命名的元素之一)能够分享这些特征; 但是,因为这个元素的半衰期是以毫秒为单位测量的,所以没有人能够直接测试它。Oganesson完成了元素周期表的第七个周期,所以如果有人设法合成元素119(并且 这样做的竞赛已经开始),它将循环开始在碱金属柱中的第八行。
由于周期性所产生的周期性特性使得表格得名,一些化学家更喜欢将 门捷列夫的表格视为一个圆圈。