这是国内首个获批的具有自主知识产权的新冠肺炎中和抗体联合治疗药物。
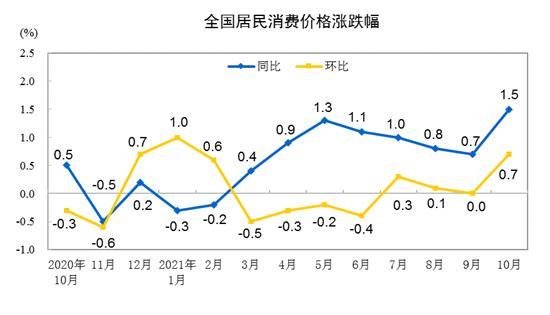
12月8日,国家医药产品管理局官网发布消息,批准腾盛华创医药科技(北京)有限公司新冠肺炎中和抗体联合治疗药物AMBA-196和ROMI-198的注册申请
这是国内首个获批的具有自主知识产权的新冠肺炎中和抗体联合治疗药物。
根据《药品管理法》的相关规定,国家美国食品药品监督管理局(SFDA)按照特殊药品审批程序进行了紧急审评审批,批准将上述两种药物联合用于治疗成人和青少年(12-17岁,体重40公斤)中的新型冠状病毒感染(新冠肺炎)患者,这些患者病情较轻且常见,并伴有重症(包括住院或死亡)的高危因素。其中青少年(12-17岁,体重40公斤)符合审批条件。
据报道,AMB和洛西是与深圳市第三人民医院和清华大学合作从新型冠状病毒(新冠肺炎)患者中获得的单克隆中和抗体。生物工程技术被特别应用于降低抗体介导的依赖性增强的风险,延长血浆半衰期,以获得更持久的治疗效果。
三方合作以来,AMBA/ROMI的联合治疗从中和抗体的初步分离筛选到国际三期临床试验的完成,得到了快速推进,最终在不到20个月的时间里获得了美国食品药品监督管理局州的批准。
中和抗体治疗对突变株有什么影响?
据《科技日报》报道,滕胜博药物中和抗体治疗的837例新冠肺炎患者在4大洲、6个国家、111家临床试验机构的三期临床试验结果显示,抗体联合药物可降低住院率和死亡率78%,药物组治疗28天后实现零死亡,对照组8例患者死亡。
除了临床研究的积极成果,其实在急诊获批之前,上面提到的中和抗体疗法已经在临床治疗中发挥了作用。针对国内由Delta突变株引起的新冠肺炎疫情,腾盛姚博自2021年6月以来,累计捐赠AMB、country近3000份,涉及粤滇苏等13个省(区),累计救治患者近900人,是单个国家中经历过这种中和抗体的患者最多的一次。
腾博药业总裁、大中华区总经理罗永清表示,此次获批是基于美国国立卫生研究院(NIH)支持的ACTIV-2三期临床试验,包括847例患者的中期和终末期阳性结果。最终结果显示,与安慰剂相比,AMBA/ROMI联合疗法将新冠肺炎临床进展较高的门诊患者的住院和死亡风险降低了80%(中期结果为78%),这具有统计学意义。同时,无论是早期(症状出现后5天内)开始治疗的受试者,还是晚期(症状出现后6-10天内)开始治疗的受试者,住院率和死亡率均显著降低,为新冠肺炎患者提供了更长的治疗窗口期。
“AMBA/ROMI联合疗法的批准为中国带来了新冠肺炎首个特效药。这种联合疗法在国际多中心试验中表现出了优异的安全性和保护性,是世界上唯一一种评估变异感染治疗效果并获得最佳数据的抗体药物。”联合疗法主要开发者之一、清华大学全球健康与传染病研究中心主任张教授表示,抗体联合疗法为中国抗击疫情提供了世界级的治疗方案,为中国乃至全球疫情防控做出了重要贡献。
目前,腾盛博医药尚未发布关于是否变异的相关信息治疗药物在新冠肺炎的出现,让人们看到了全球抗疫的新希望。
关于治疗药物与疫苗的关系,张教授曾强调,预防是任何疾病的第一要务。“有药就不打疫苗”是疫苗和药物的误解。

数据:新冠肺炎为市民接种加强针。陈照片
西南证券医药行业首席分析师杜向阳曾表示,新冠肺炎疫苗与新冠肺炎治疗药物(包括中和抗体、小分子口服药物)不是取舍关系,而是共同构建“检测-预防-治疗”防疫体系的有效工具。
杜向阳分析,未来,在新冠肺炎疫情大概率常态化、变异毒株频发的背景下,疫苗更新迭代仍将是防疫关键。中国仍然需要加强注射,大量海外国家仍然需要疫苗来完成基本的免疫工作,所以新冠肺炎的疫苗仍然有很大的空间,还没有触及天花板。
中国还有哪些新冠肺炎治疗药物?
国内新冠肺炎药物主要围绕抑制病毒复制、阻断病毒进入细胞、调节人体免疫系统3条技术路线,其中多款治疗药物有望在12月有新进展。
中科院微生物所和君实生物团队共同研发的中和抗体疗法JS016,也属于中和抗体类药物。此前,该药在中国大陆、中国香港、菲律宾、乌克兰等地完成国际多中心Ib/II期临床试验全部患者入组及全部观察期、全部临床数据的清理和统计,预计12月得出临床试验结论。
河南师范大学研发的阿兹夫定是一款口服新冠治疗药物,正在中国、巴西、俄罗斯开展III期临床试验。据悉,该药力争12月申请国内附条件批准上市。
开拓药业的普克鲁胺是另一款口服新冠治疗药物,目前正在中国、美国、巴西等国家开展三项国际多中心III期临床试验,分别针对轻中症新冠患者和重症新冠患者,入组工作正在有序开展中。进展最快的是在美国等国家开展的针对轻中症新冠患者的III期临床试验,中期数据预计12月份发布。